




Patiënten met gemetastaseerd prostaatcarcinoom en predictieve biomarkers komen steeds vaker in aanmerking voor doelgerichte of immunotherapie. Hoe en wanneer deze biomarkers worden bepaald varieert echter aanzienlijk tussen behandelaars en centra. In het Radboudumc te Nijmegen ontwikkelde een multidisciplinair team recentelijk een zorgpad dat de moleculaire diagnostiek bij gemetastaseerd prostaatcarcinoom eenduidiger moet organiseren. Internist-oncoloog dr. Niven Mehra vertelt hoe het zorgpad tot stand kwam, is opgezet en geïmplementeerd.
Bij patiënten met progressief, gemetastaseerd castratieresistent prostaatcarcinoom (mCRPC) na eerdere behandeling met enzalutamide dan wel abirateron plus prednison kunnen genetische afwijkingen in BRCA1 en BRCA2 – in de tumor en/of in de kiembaan – aanleiding geven tot doelgerichte therapie met de PARP-remmer olaparib. “Daarnaast is de verwachting dat behandeling met olaparib, abirateron en prednison binnenkort een optie wordt bij patiënten met niet eerder behandeld mCRPC en BRCA1/2-afwijkingen of andere biomarkers van DNA-schadehersteldeficiëntie, waaronder mutaties in ATM, CDK12 en PALB2”, vertelt Niven Mehra.
Hij vervolgt: “Verder komen patiënten met mCRPC en mismatch-repairdeficiëntie (dMMR) in de reguliere zorg in aanmerking voor immunotherapie met nivolumab sinds de beoordeling van resultaten van de DRUP-studie door Zorginstituut Nederland.1 Samen met de BRCA-afwijkingen komt dit nu neer op 12-15% van de patiënten met mCRPC. In de nabije toekomst kan dit stijgen naar ongeveer 35% van de patiënten, wanneer er een vergoeding beschikbaar komt voor PARP-remmers in combinatie met abirateron en prednison voor patiënten met mutaties in een bredere set van genen. Bovendien komen uitbehandelde mCRPC-patiënten met andere genetische afwijkingen mogelijk in aanmerking voor een doelgerichte behandeling vanuit de DRUP-studie.”
Door al deze opties is het van groot belang om patiënten met mCRPC zo vroeg mogelijk te testen op de aanwezigheid van actionable genetische afwijkingen in de tumor en de kiembaan. Momenteel komt dit erop neer dat bij patiënten met een positieve familieanamnese eerst getest zou moeten worden op BRCA1- en BRCA2-kiembaanmutaties, vervolgens – indien nodig – op BRCA1- en BRCA2-mutaties en dMMR in de tumor en binnenkort waarschijnlijk op mutaties in een bredere set genen.
“De ervaring leert dat dit in de dagelijkse praktijk nog lang niet overal op deze manier gebeurt. Daarnaast ben ik van mening dat iedere patiënt met een tumor die dMMR is of een actionable mutatie heeft in een kankerpredispositiegen die mogelijk uit de kiembaan afkomstig is, in een moleculaire tumorboard besproken zou moeten worden, maar ook dit gebeurt nog té weinig”, aldus Mehra.
Zorgpad
Vanaf 2020 liep in het Radboudumc de observationele studie PROMPT waarin bij 300 patiënten met mCRPC de waarde van vroegtijdige en routinematige moleculaire diagnostiek werd onderzocht.2 “Deze studie heeft ervoor gezorgd dat in het Radboudumc de processen en de kwaliteit van de zorg bij mCRPC verbeterden en er een zorgpad moleculaire diagnostiek bij prostaatkanker werd opgesteld. Aan dit zorgpad was behoefte, omdat we ernaar streven om iedere patiënt optimale zorg aan te bieden.
Vóór PROMPT was dit qua moleculaire diagnostiek niet altijd het geval en werd bijvoorbeeld niet bij alle mCRPC-patiënten naar de familiegeschiedenis gekeken, varieerde de timing van de moleculaire diagnostiek en werden de tests niet altijd op het juiste materiaal uitgevoerd. Kortom, er was sprake van te veel heterogeniteit met mogelijk suboptimale diagnostiek en zorg. Dat deze heterogeniteit ook tussen centra bestond, bleek recentelijk uit een landelijke studie onder 39 behandelaars van prostaatkanker.”3
Het zorgpad voor de moleculaire diagnostiek bij prostaatkanker werd ontwikkeld door een multidisciplinair team van het Radboudumc, dat naast Mehra bestond uit onder andere promovenda medische oncologie Iris Kloots, MSc., klinisch geneticus dr. Marleen Kets en laboratoriumspecialist klinische genetica en KMBP’er prof. dr. Marjolijn Ligtenberg. Mehra: “De inhoud van het zorgpad is met name gericht op mCRPC en gebaseerd op nationale en internationale richtlijnen, waaronder die van de Vereniging Klinische Genetica Nederland (VKGN), EAU en ESMO. Hoewel er voor gemetastaseerd, hormoongevoelig prostaatcarcinoom (mHSPC) momenteel geen indicatie is voor doelgerichte therapie, adviseert het zorgpad wel om deze patiënten te verwijzen naar een klinisch geneticus als zij een positieve familiegeschiedenis hebben volgens de criteria van de VKGN.”4
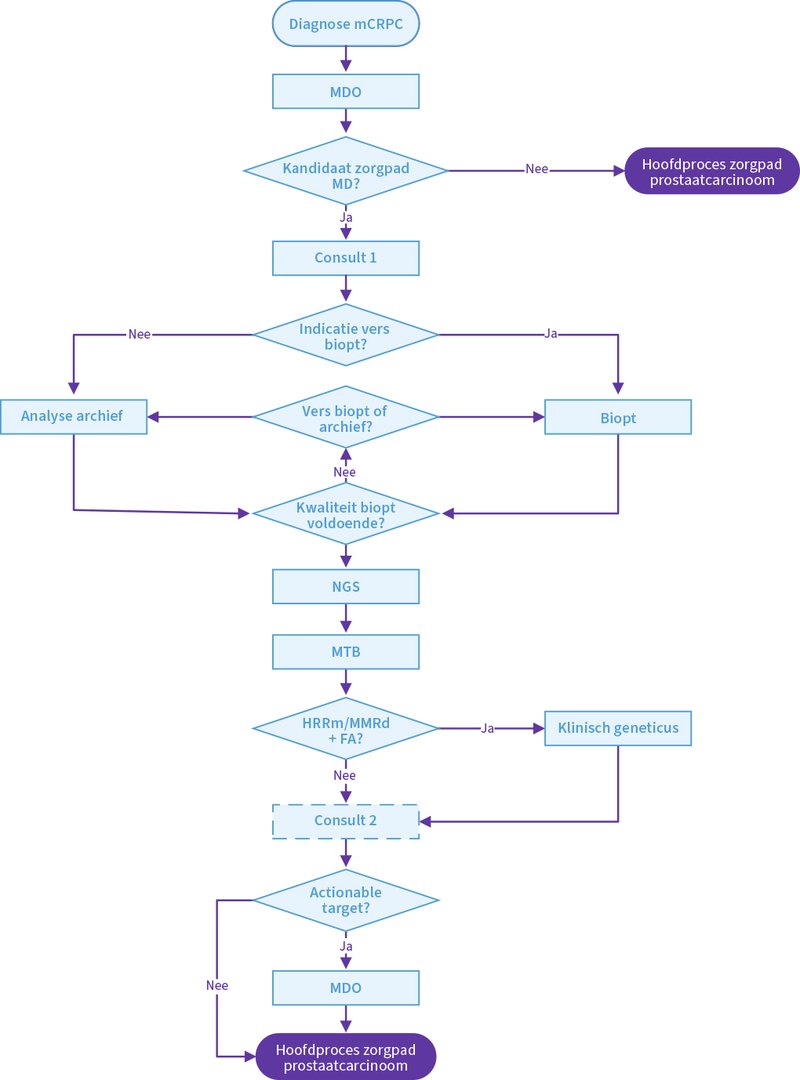

mCRPC
Patiënten met mCRPC die volgens het multidisciplinair overleg (MDO) in aanmerking komen voor het zorgpad moleculaire diagnostiek krijgen een eerste consult bij een internist-oncoloog of uroloog (zie Figuur 1). Tijdens dit consult wordt de familiegeschiedenis uitvoerig in kaart gebracht en wordt de patiënt voorgelicht over de moleculaire analyses van afwijkingen in de kiembaan en/of tumor en de mogelijke gevolgen voor de patiënt en zijn familieleden.
Als de patiënt instemt met de moleculaire diagnostiek, wordt vervolgens gekeken of er een indicatie is voor het nemen van een vers biopt van een metastase of primair tumorweefsel. Als dit niet het geval is, kunnen de moleculaire analyses vaak ook worden gedaan op archiefmateriaal. “Dit is mogelijk als de periode tussen mHSPC en mCRPC maximaal drie jaar duurde en de tumor een Gleason-score van minimaal acht heeft, omdat dan de kans relatief klein is dat de genetische opmaak van de tumor in de loop van de tijd sterk is veranderd. Overigens loopt er momenteel een studie in het Radboudumc waarin bij enkele honderden patiënten met mCRPC wordt onderzocht of archiefmateriaal resulteert in een moleculaire uitslag die vergelijkbaar is met die van vers tumorweefsel voor de belangrijkste actionable targets. Als dit het geval is, zou je in het zorgpad de optie kunnen opnemen dat al in het mHSPC-stadium wordt getest op genetische afwijkingen”, vertelt Mehra.
Als het tumorweefsel van voldoende kwaliteit is en minimaal 30% tumorcellen bevat, wordt een panel van ruim 500 genen gesequenced met next-generation sequencing en de uitslag besproken in een moleculaire tumorboard. Mehra: “In deze uitslag beperken we ons tot de actionable en prognostische prostaatkanker-geassocieerde genen en de genen die relevant zijn voor de DRUP-studie. Of er reden is om te verwijzen naar een klinisch geneticus voor erfelijkheidsonderzoek na een afwijkende tumortest is afhankelijk van de gevonden afwijking en de familieanamnese.” Hierbij wordt een tabel met een leidraad op de website ’Arts en genetica’ gebruikt.5
Na het vaststellen van een kiembaanmutatie bij de patiënt is familieonderzoek mogelijk en kunnen familieleden met een erfelijk verhoogd risico op kanker preventieve maatregelen nemen. Patiënten met somatische of kiembaanmutaties die aanleiding geven tot doelgerichte behandeling of immunotherapie worden vervolgens in het MDO besproken. Patiënten zonder deze mutaties komen in aanmerking voor het reguliere zorgpad voor mCRPC.
“Hoewel het beschreven zorgpad nu alleen in het Radboudumc wordt gevolgd, merk ik dat ook andere centra geïnteresseerd zijn. Mede omdat er in het veld behoefte is aan uniformiteit, denken wij dat het zorgpad zich uitstekend leent voor landelijke implementatie”, besluit Mehra.
Referenties
1. DRUP Study. Te raadplegen via drupstudy.nl/
2. PROMPT-studie. Te raadplegen via www.kanker.nl/trials/1136-prompt---studie-prostaatkanker
3. Mehra N, et al. Eur Urol Open Sci 2023;49:23-31.
4. Richtlijnen van Verenging Klinische Genetica Nederland en de Stichting Opsporing Erfelijke Tumoren. Te raadplegen via vkgn.stoet.nl/
5. Arts en genetica. Te raadplegen via artsengenetica.nl/
Dr. Robbert van der Voort, medical writer
Oncologie Up-to-date 2023 vol 14 nummer 6