




Door de effectiviteit van de huidige behandelingen zijn de gangbare technieken vaak onvoldoende gevoelig om de minimale restziekte bij multipel myeloom te bepalen. Daarom ontwikkelden medisch immunoloog dr. Hans Jacobs en collega’s van de afdeling Laboratoriumgeneeskunde van het Radboudumc te Nijmegen en de afdelingen Neurologie en Klinische Chemie van het Erasmus MC te Rotterdam recentelijk een methode op basis van massaspectrometrie waarmee de ziekteactiviteit waarschijnlijk met een factor honderd tot duizend gevoeliger bepaald kan worden.
Multipel myeloom (MM) wordt gekarakteriseerd door de klonale proliferatie van maligne plasmacellen in het beenmerg. Daarnaast produceren deze plasmacellen een uniek antilichaam, het M-proteïne, dat men als biomarker in het bloed kan meten. Door de proliferatie van maligne plasmacellen en de productie van het M-proteïne hebben MM-patiënten vaak onder andere cytopenieën, nierproblemen en lytische laesies in de botten. “Om bij patiënten met deze klachten een diagnose te stellen dient laboratoriumdiagnostiek uitgevoerd te worden. Hierbij vormt de detectie van het M-proteïne in het serum door elektroforese en immunofixatie een belangrijk onderdeel. Met deze technieken kan men niet alleen de aanwezigheid van een M-proteïne aantonen, maar ook het proteïne verder karakteriseren en kwantificeren. Het M-proteïne kan echter niet alleen als biomarker gebruikt worden tijdens het stellen van de diagnose, maar ook voor het monitoren van het ziekteverloop tijdens en na behandeling. Zo vormt de kwantificering van het M-proteïne een belangrijk onderdeel van de responsbepaling bij MM, zoals bijvoorbeeld gedefinieerd door de International Myeloma Working Group”, aldus Hans Jacobs.1
Minimale restziekte
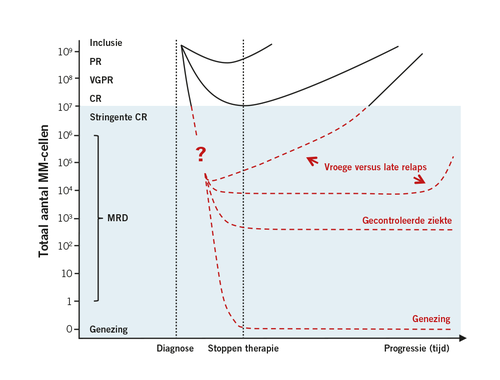
Omdat de huidige behandelingen voor MM steeds vaker gepaard gaan met een hoog responspercentage en diepe en duurzame responsen, is de bepaling van de minimale restziekte (MRD) belangrijker dan ooit. De MRD geeft namelijk een beeld van de snelheid en diepte van de respons en daarmee inzicht in het moment waarop de ziekte zal recidiveren (zie Figuur 1). De verwachting is dan ook dat de MRD in toenemende mate de te volgen behandelstrategie zal bepalen.
Jacobs: “MRD-tests richten zich op de detectie van MM-cellen in beenmergaspiraat door middel van flowcytometrie of moleculaire technieken. In onze optiek is het herhaaldelijk bepalen van MRD aan de hand van beenmergpuncties echter niet de meest wenselijke methode. Ten eerste is de verspreiding van MM-cellen over het beenmerg meestal patchy, wat een adequate kwantificering lastig maakt. Daarnaast is het herhaaldelijk nemen van beenmergaspiraten een aanzienlijke belasting voor de patiënt. Verbetering van de detectiemethoden is dan ook onderwerp van intensief onderzoek. Ons onderzoek richt zich op het gevoelig meten van ziekteactiviteit in het bloed. Omdat elk M-proteïne een unieke structuur heeft, vergt de detectie en kwantificering van elk M-proteïne een gepersonaliseerde benadering, iets wat met de reguliere methoden soms een uitdaging is.”
Massaspectrometrie
Om M-proteïnen in het bloed op een hanteerbare, zeer gevoelige en patiëntvriendelijke manier te bepalen bedachten Jacobs en collega’s een nieuwe benadering. “We kwamen tot de conclusie dat massaspectrometrie een geschikte techniek kon zijn en konden al snel aantonen dat eiwitten zoals immuunglobulinen hiermee uitstekend te detecteren en te kwantificeren zijn.2 Aanvankelijk richtte ons onderzoek zich op de constante domeinen van de immuunglobulinen. Nu willen we de methode verbeteren door ons te focussen op de hypervariabele domeinen. Deze zogenoemde VDJ-domeinen zijn uniek voor elk M-proteïne en dus voor elk MM. Indien we nu met standaardtechnieken de DNA-sequentie van die domeinen bepalen, kunnen we de unieke aminozuurvolgorde in het M-proteïne als een myeloomspecifieke ‘barcode’ lezen. Dit laatste doen we door in een druppel bloed de M-proteïnen enzymatisch in peptiden te knippen, de bewuste barcodes daaruit te scheiden en met behulp van selected-reaction-monitoring-massaspectrometrie te analyseren. Door bovendien de concentratie van de peptiden te meten tegen één of meer gelabelde referentiepeptiden kunnen we op een zeer gevoelige manier, en op elk moment, de concentratie van het peptide bepalen. De methode op bloed lijkt zelfs zo gevoelig te zijn dat er mogelijk in de toekomst geen beenmerg meer nodig is om ziekteactiviteit te meten. Hierdoor zijn niet alleen de resultaten beter reproduceerbaar, maar is de methode ook patiëntvriendelijker.”
Daarnaast blijkt uit een zijproject van Jacobs en zijn collega’s dat er door het gebruik van massaspectrometrie tijdens doelgerichte therapieën geen interferentie met de detectie van het M-proteïne optreedt.3 Bij veel doelgerichte therapieën worden namelijk grote hoeveelheden antilichamen gebruikt die de detectie van het M-proteïne met de gangbare methoden bemoeilijken.
KWF-project
De eerste resultaten met de nieuwe methode waren meteen veelbelovend. “Bij de eerste MM-patiënten konden we met de nieuwe methode het M-proteïne al honderd tot duizend keer gevoeliger meten dan met de reguliere M-proteïnediagnostiek. Daarom verwachten we dat we met deze methode veel gevoeliger ziekteactiviteit kunnen meten dan met de huidige bloedtests. Of dat ook inderdaad het geval is onderzoeken we nu in het kader van een project dat recentelijk door KWF Kankerbestrijding met een subsidie van € 510.000 gehonoreerd werd. In dit project zullen we als eerste de gebruikte massaspectrometrie en resultatenanalyse optimaliseren. Vervolgens wordt bij 100 MM-patiënten nagegaan of het mogelijk is om in het bloed peptiden van het M-proteïne te detecteren en kwantificeren. Daarnaast gaan we deze methode vergelijken met de reguliere assays en zullen wij ten slotte bij een positieve uitkomst alvast de vertaling naar een daadwerkelijke klinische toepassing voorbereiden. Het leuke van dit project is dat ook de industrie en HOVON snel geïnteresseerd waren en meedenken hoe deze methode van een academische setting naar een breed inzetbare klinische toepassing vertaald kan worden”, aldus Jacobs.
Mogelijk kan de veelbelovende test in de toekomst niet alleen voor MM toegepast worden, maar ook voor de diagnostiek bij andere monoklonale gammopathieën, zoals amyloïdose en Waldenström’s macroglobulinemie.
Referenties
1. Durie BG, et al. Leukemia 2006;20:1467-73.
2. Van Duijn MM, et al. Anal Chem 2015;87:8268-74.
3. Zajec M, et al. J Proteome Res 2018;17:1326-33.
Dr. Robbert van der Voort, medical writer
Oncologie Up-to-date 2018 vol 9 nummer 4
Commentaar prof. dr. Sonja Zweegman, internist-hematoloog, VUmc, Amsterdam
Hans Jacobs en collega’s zijn de weg aan het plaveien voor een nieuwe test naar minimale restziekte (MRD) en dat is van groot belang. De wortels liggen in het zoeken naar een test die het monoklonale M-proteïne van de patiënt kon onderscheiden van de therapeutisch toegediende monoklonale antistof zoals bijvoorbeeld daratumumab, waarvoor tegenwoordig de daratumumab-immunofixatie-elektroforesereflexassay (DIRA) noodzakelijk is. Die assay bleek tevens MRD goed aan te kunnen tonen.
Recente studies laten zien dat niet complete remissie, maar met name de afwezigheid van MRD, gedefinieerd als minder dan 1 per 1x105 cellen, van belang is voor een goede prognose. Dat was al bekend door pionierswerk van de Spaanse PETHEMA-groep, waarin middels flowcytometrie aangetoonde MRD van groot belang bleek voor zowel de prognose, bij jongeren én oudere patiënten met nieuw-gediagnosticeerd MM, als tijdens het recidief.1,2,3
Vervolgens bleek dat de wijze waarop MRD bereikt wordt niet uitmaakt voor de prognose. De Franse IFM-studie, waarin gerandomiseerd werd naar VRD (bortezomib, lenalidomide, dexamethason) met of zonder autologe stamceltransplantatie (autoSCT), liet zien dat de prognose bij de MRD-negatieve patiënten beter was dan bij de MRD-positieve patiënten, onafhankelijk van het feit of de patiënten alleen VRD of VRD plus autoSCT ondergingen. Wel bleek de kans op het bereiken van een MRD-negatieve situatie hoger indien patiënten een autoSCT hadden ondergaan (79% versus 65%).4 Ook in de relapssetting van de CASTOR- en de POLLUX-studie, waarin daratumumab werd toegevoegd aan dexamethason plus respectievelijk bortezomib of lenalidomide, werd aangetoond dat onafhankelijk van de manier waarop MRD-negativiteit bereikt werd, de prognose beter was voor MRD-negatieve patiënten.5,6 Wel was het percentage MRD-negatieve patiënten veel hoger indien daratumumab werd toegevoegd.
Het bereiken van een MRD-negatieve status is dus belangrijk, omdat het in een betere overleving resulteert. Hiermee is het een vroege surrogaatuitkomstmaat voor klinische studies, waarmee het belang van de studie van Jacobs en collega’s duidelijk is. De huidige MRD-metingen vereisen beenmergonderzoek. Dit onderzoek is voor patiënten belastender dan een bloedafname en ook weten we dat plasmacellen zich niet diffuus in het beenmerg bevinden, maar gelokaliseerd, en dus kan het afgenomen beenmerg fout-negatief zijn. Dus hulde aan de onderzoekers.
Er blijven echter nog wel vragen over en daarom is het mooi als deze techniek van MRD-bepaling in de huidige HOVON-studies geïmplementeerd wordt. Ten eerste is nog niet bekend of de prognostische waarde van deze techniek op zijn minst gelijk of beter is dan de huidige MRD-bepalingen. Pas als dat aangetoond is, kan de test de huidige MRD-bepaling middels flowcytometrie of moleculaire technieken vervangen. Ten tweede is nog niet bekend of met deze test de toegevoegde waarde van PET-bepaalde patchy botlokalisatie vervalt, hetgeen ik betwijfel. Immers, het is de vraag of lokale patchy ziekte wel aanleiding geeft tot minimale hoeveelheden M-proteïne in het bloed. En als laatste, maar dat is meer van algemene aard, is de hamvraag natuurlijk of de MRD-status van de patiënt ook gaat leiden tot het aanpassen van de therapie. Dat varieert van wijzigen van de therapie bij het aantoonbaar blijven van MRD tot het staken van langdurige onderhoudstherapie bij het bereiken van een persisterende MRD-negatieve status. Dat moet eerst in prospectief gerandomiseerd onderzoek aangetoond worden, maar dat klinische onderzoekers met Jacobs en collega’s contact moeten opnemen moge duidelijk zijn.
Referenties
1. Paiva B, et al. Blood 2008;112:4017-23.
2. Paiva B, et al. Haematologica 2015;100:e53-5.
3. Paiva B, et al. Blood 2016;127:3165-74.
4. Attal M, et al. N Engl J Med 2017;376:1311-20.
5. Lentzsch S, et al. J Clin Oncol 2017;35(suppl):8036.
6. Bahlis NJ, et al. J Clin Oncol 2017;35(suppl):8025.