



Dankzij een aanzienlijke werkzaamheid en beperkte toxiciteit is immunotherapie met immuuncheckpointremmers een gevierde behandeling bij een groeiend aantal maligniteiten. Toch is er maar weinig bekend over de immuunresponsen die door deze therapie worden bevorderd. Sinds kort gebruiken onderzoekers van de afdeling Tumorimmunologie van het Radboudumc te Nijmegen, waaronder de promovendi Mark Gorris en Lieke van der Woude, tevens patholoog in opleiding, een nieuwe methode waarmee in de tumor meerdere immuunmarkers tegelijkertijd geanalyseerd kunnen worden.
Immunotherapie met CTLA-4-, PD-1- en PD-L1-remmers is reeds effectief gebleken bij diverse solide en hematologische maligniteiten en veelbelovend bij een groeiend aantal andere. Toch blijft het percentage duurzame responsen over het algemeen beperkt en zijn de behandelingen vaak gemoeid met hoge kosten. Verbeterde kennis van de immunologische respons tegen tumoren, de remming of activering van andere immuuncheckpointreceptoren en doelgerichtere patiëntselectie op basis van biomarkers zouden hierin verandering kunnen brengen. Bovendien zal hiervan het belang waarschijnlijk alleen maar toenemen door de introductie van nieuwe immuuncheckpointremmers en gecombineerde en sequentiële (immuno)therapieën. “Het lijkt dan ook aannemelijk dat een beter begrip van de kenmerken van, en de interactie tussen tumor- en immuuncellen in het micromilieu van de tumor de uitkomst van immunotherapie ten goede zal komen”, aldus Lieke van der Woude.
Voor de bestudering van immuunreacties en andere biologische processen in tumoren zijn verschillende technieken voorhanden. “Meestal bestudeert men tumoren met immunohistochemie (IHC) waarmee gewoonlijk de expressie van één marker per weefselcoupe wordt bepaald. Voor de analyse van meerdere markers moeten dan sequentiële coupes gekleurd worden. Vaak is de hoeveelheid tumorweefsel echter beperkt. Sinds kort biedt een aantal technieken echter de mogelijkheid om per coupe meerdere markers te analyseren. Een voorbeeld is de tyramide signal amplification(TSA)/Opalmethode van Perkin Elmer”, vertelt Mark Gorris.
TSA-methode
De TSA-methode is gebaseerd op de ‘kleuring’ van eiwitten, zoals immuunreceptoren, in weefselcoupes door reactieve tyramidemoleculen (zie Figuur 1). Hierbij bestaat de eerste stap uit de specifieke binding van een antilichaam aan de marker van interesse, bijvoorbeeld PD-1. In de tweede stap wordt dit antilichaam gebonden door een isotypespecifiek antilichaam waaraan het enzym horseradish peroxidase(HRP) is gekoppeld. Indien de coupe vervolgens wordt geïncubeerd met een oplossing met tyramidemoleculen, zal het HRP deze moleculen dusdanig activeren dat zij een covalente binding zullen aangaan met alle tyrosines in de directe omgeving. Dit heeft een aanzienlijke amplificatie van de ‘kleuring’ tot gevolg. Omdat ongebonden tyramidemoleculen worden weggewassen, zullen echter slechts de tyrosines van de marker, de gebonden antilichamen en het HRP door de tyramidemoleculen gekleurd worden. Indien de tyramidemoleculen gekoppeld zijn aan een fluorofoor, zoals die van het Opalsysteem, kan de aankleuring vervolgens met bijvoorbeeld een fluorescentiemicroscoop gelokaliseerd en gekwantificeerd worden. Bovendien kunnen tegelijkertijd meerdere markers geanalyseerd worden door het uitvoeren van sequentiële kleuringen met tyramidemoleculen die zijn gekoppeld aan fluoroforen met verschillende emissiespectra.
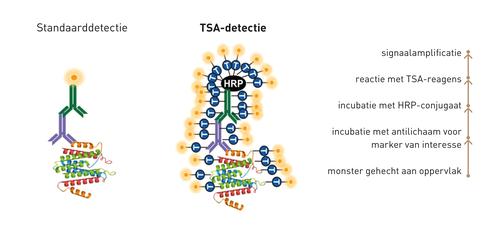
Meerdere receptoren
Recentelijk lieten Gorris en collega’s zien dat het mogelijk is om met de TSA-methode in paraffinemateriaal van tumorweefsels tegelijkertijd de expressie van zeven verschillende markers, waaronder immuun(checkpoint)- en tumormarkers, te analyseren. Gorris: “Hiervoor hebben we eerst alle antilichamen in enkel- en combinatiekleuringen gevalideerd.1 Uiteindelijk waren we in staat om, in combinatie met een DAPI-kernkleuring, een tumormarker en een T-celmarker, tegelijk vijf verschillende immuuncheckpointreceptoren te kleuren. Op deze manier kunnen we dus analyseren op welke cellen en op welk niveau verschillende immuuncheckpointreceptoren tot expressie komen. Bovendien is het een groot voordeel dat met deze zogenoemde ‘acht-kleurenmultiplex-IHC’ verschillende tumortypen onderzocht kunnen worden.”
KWF Kankerbestrijding
Op grond van deze positieve resultaten stelden prof. dr. Carl Figdor en prof. dr. Jolanda de Vries van de afdeling Tumorimmunologie van het Radboudumc een projectvoorstel op dat recentelijk door KWF Kankerbestrijding gehonoreerd werd met een bedrag van bijna € 700.000. Gorris: “Het belangrijkste doel van dit project is om met de nieuwe methode de locatie en het fenotype van onder andere T-cellen, tumorcellen, macrofagen en myeloid-derivedsuppressorcellen bij patiënten met gevorderd melanoom of longkanker die met immuuncheckpointremmers behandeld werden, in kaart te brengen. Daarnaast zal de expressie van immuuncheckpointreceptoren worden bepaald. Vervolgens zullen we onderzoeken of bepaalde gegevens correleren met de klinische respons.” Van der Woude vult aan: “Dit project richt zich met name op de primaire tumor van deze patiënten. We verwachten namelijk dat het micromilieu van deze tumor antwoord kan geven op de vraag waarom bij patiënten nog vóór behandeling wel of niet een antitumorrespons geïnitieerd wordt en waarom sommige patiënten wel en andere niet op immuuncheckpointblokkade reageren. Momenteel zijn we, in samenwerking met een aantal andere centra, waaronder het Isala in Zwolle, Erasmus MC te Rotterdam en het UMC Groningen, druk bezig met het verzamelen van tumorweefsel van deze behandelde patiënten.”
“De verwachting is dat immuunresponsen bij kankerpatiënten in de toekomst op een veel bredere manier in kaart gebracht zullen worden. Bijvoorbeeld door een gecombineerde moleculaire en immunologische analyse van bijvoorbeeld zowel de primaire tumor, metastasen als liquid biopsies. Onze acht-kleurenmultiplex-IHC past heel goed in die context. Daarnaast zal het aantal antagonisten, en sinds kort ook agonisten, van immuuncheckpointreceptoren in de toekomst toenemen. Hopelijk kan onze analyse meer inzicht geven in de rol die deze receptoren spelen tijdens de antitumorimmuunrespons”, besluit Gorris.
Referentie
1. Gorris MA, et al. J Immunol 2018;200:347-54.
Dr. Robbert van der Voort, medical writer
Immunoncologie.nl 2018 vol 2 nummer 2