




De NADINA-2021-studie is een investigator-initiated studie bij melanoom stadium III op initiatief van het Antoni van Leeuwenhoek, Amsterdam. Het is de allereerste fase 3-studie naar neoadjuvante immunotherapie bij melanoom. Prof. dr. Christian Blank, internist-oncoloog in het Antoni van Leeuwenhoek en principal investigator van de studie, geeft in dit artikel details van het studiontwerp, de belangrijkste in- en exclusiecriteria, de uitkomstmaten en de planning met de combinatie van ipilimumab en nivolumab. Alle veertien Nederlandse melanoomcentra gaan meedoen aan de studie, die eind juli begint.
De prognose van patiënten met stadium III-melanoom is nog altijd slecht. Zonder systemische behandeling ligt de algehele overleving (OS) na vijf jaar op 30-60%. De huidige standaard adjuvante behandeling voor patiënten met operabele ziekte is nivolumab, pembrolizumab of de combinatie van een BRAF- en een MEK-remmer, afhankelijk van de BRAF-mutatiestatus. Maar ook met adjuvante therapie is de recidiefvrije overleving (RFS) onvoldoende. Momenteel is er geen standaard neoadjuvante behandeling voor deze patiëntengroep, maar er zijn wel klinische data die wijzen op een mogelijk gunstige rol voor neoadjuvante immunotherapie. Christian Blank: “De gerandomiseerde fase 3-NADINA-studie gaat deze optie nu verder evalueren.”
Eerdere studies
Gevraagd naar de wetenschappelijke basis voor de NADINA-studie noemt Blank de OpACIN-, de OpACIN-neo en de PRADO-studie: “Deze studies hebben bemoedigende resultaten laten zien met ipilimumab en nivolumab (ipi + nivo) als neoadjuvante behandeling bij stadium III-melanoom. Deze zijn voor de OpACIN- en de OpACIN-neo-studie mooi samengevat in een recent artikel in Nature Medicine.”1
In de fase 1b-OpACIN-studie bleek dat twee kuren ipi + nivo tot een verrassend hoog percentage pathologische respons (pRR) leidde en dat neoadjuvante checkpointremming een sterkere T-celrespons gaf dan adjuvante behandeling met checkpointremmers. Na een mediane follow-up van vier jaar had geen van de patiënten met een pRR een recidief van het melanoom.
De immunotherapie in OpACIN ging gepaard met veel immuungerelateerde graad 3/4-toxiciteit (90%). In de daaropvolgende gerandomiseerde fase 2-OpACIN-neo-studie zijn daarom drie combinaties van verschillende lage doseringen ipi + nivo onderzocht. Hieruit kwam de combinatie ipi 1 mg/kg + nivo 3 mg/kg als beste optie voor twee kuren neoadjuvante behandeling naar voren, met een pRR van 78% en 20% graad 3/4-immuungerelateerde bijwerkingen.
De PRADO-studie, in een extensiecohort van OpACIN-neo, bevestigde de hoge pRR en de veiligheid van het optimale OpACIN-neo-schema van ipi 1 mg/kg + nivo 3 mg/kg. Blank presenteerde de initiële resultaten tijdens de ASCO Annual Meeting 2020: 72% pRR en 22% graad 3/4-immuungerelateerde bijwerkingen in de eerste twaalf weken. Bij een aanzienlijk deel van de patiënten (60%) werd geen therapeutische lymfeklierdissectie uitgevoerd na de neoadjuvante behandeling. Patiënten bij wie alleen dissectie van de indexlymfeklier werd uitgevoerd, hadden minder chirurgiegerelateerde bijwerkingen dan patiënten met therapeutische lymfeklierdissectie (41% versus 81%).2
Goede surrogaatuitkomstmaat
De keuze voor pRR als surrogaatuitkomstmaat in de eerdere trials en nu ook in de NADINA-studie wordt onderbouwd door een recente gecombineerde analyse van 192 patiënten die in verschillende neoadjuvante trials een anti-PD-1-antilichaam of de combinatie van een BRAF- en een MEK-remmer hadden gehad. De pRR correleerde goed met de RFS en de OS.3
Ontwerp NADINA
De volledige titel van de studie luidt: Phase 3 trial comparing response drive neo-adjuvant combination of ipilimumab + nivolumab versus adjuvant nivolumab. Het studieontwerp is weergeven in Figuur 1. Patiënten worden gerandomiseerd tussen behandeling met twee kuren ipi 80 mg + nivo 240 mg (arm A) of up-front therapeutische lymfeklierdissectie gevolgd door de standaard adjuvante behandeling met nivo gedurende een jaar en eventueel adjuvante radiotherapie (arm B).
De aard van de postoperatieve behandeling in arm A hangt af van de uitkomst van de neoadjuvante behandeling en de BRAF-status van de tumor. Patiënten met een pathologische respons worden niet verder behandeld en alleen vervolgd met twaalfwekelijkse CT-scans. Patiënten die geen pathologische respons bereiken, worden adjuvant behandeld met elf kuren nivo, als ze een BRAF-wildtype melanoom hebben, of 46 weken doelgerichte behandeling met de combinatie van een BRAF-remmer (dabrafenib) en een MEK-remmer (trametinib) in geval van een BRAF V600E/K-mutatie.
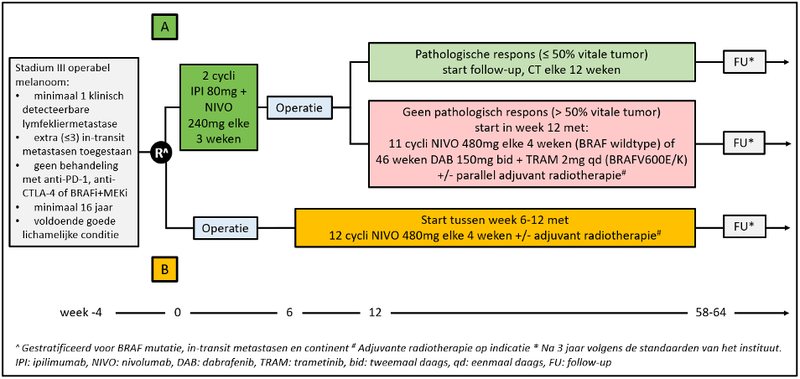
In- en exclusiecriteria
De NADINA-studie staat open voor patiënten van zestien jaar en ouder met een operabel, klinisch detecteerbaar stadium III-melanoom van de huid of onbekende origine met minimaal één aangedane lymfeklier die gebiopteerd en chirurgisch verwijderd kan worden. Daarnaast zijn maximaal drie in-transitmetastasen toegestaan. Patiënten mogen niet eerder behandeld zijn met een anti-PD-1- of anti-CTLA-4-antilichaam en mogen ook geen BRAF- of MEK-remmer gehad hebben.
Uitkomstmaten
Het hoofddoel van de studie is om vast te stellen of neoadjuvante immunotherapie met ipi + nivo van stadium III-melanoom het risico op recidivering verlaagt. De primaire uitkomstmaat is de eventvrije overleving (EFS) na 24 maanden. Het statistische ontwerp is zodanig dat een verbetering van de EFS van 60% naar 75% met een power van 90% en een tweezijdige alfa van 0,05 aangetoond kan worden. Hiervoor moeten 420 patiënten gerandomiseerd worden. Een interimanalyse is gepland na het bereiken van zestig events.
Secundaire uitkomstmaten zijn de associatie van de pathologisch respons en RFS, metastase-op-afstandvrije overleving, OS, graad 3/4-bijwerkingen en health-related quality of life.
Start eind juli
De start van NADINA staat gepland voor juli van dit jaar. Het eerste centrum waar de studie open zal gaan is het Antoni van Leeuwenhoek. Blank: “Uiteindelijk zullen alle veertien Nederlandse melanoomcentra aan de studie gaan deelnemen. Ik nodig oncologen en oncologisch chirurgen uit om patiënten die mogelijk in aanmerking komen om aan de studie deel te nemen, bij ons of een van de andere deelnemende centra aan te melden.”
Na verloop van tijd zullen ook diverse Australische, Europese (EORTC) en Amerikaanse melanoomcentra zich aansluiten. Blank verwacht dat de studie tweeëneenhalf jaar zal duren en hoopt op een snelle rekrutering van patiënten direct na de start.
Referenties
1. Rozeman EA, et al. Nat Med 2021;27:256-63.
2. Blank C, et al. J Clin Oncol 2020;38(suppl 15):10002-10002.
3. Menzies A, et al. Nat Med 2021;27:301-9.
Dr. Marinus Lobbezoo, wetenschapsjournalist
Oncologie Up-to-date 2021 vol 12 nummer 4