




De PARP-remmer niraparib wordt in een lopende, moleculair gestuurde, placebogecontroleerde fase 3-studie - de ZEST-studie - onderzocht bij twee subtypen HER2-negatieve borstkanker. Diverse Nederlandse ziekenhuizen doen mee aan deze internationale multicenterstudie, waaronder Isala in Zwolle. Dr. Wim van der Steeg, internist-oncoloog, is de principal investigator voor dit ziekenhuis. Hij legt uit hoe het studieprotocol in elkaar steekt en voor welke patiënten de studie open staat.
Hoewel de overleving van patiënten met borstkanker in stadium I-III na chirurgie verbeterd is dankzij effectieve adjuvante lokale en systemische behandelopties, blijft het risico op een recidief aanzienlijk. Voor patiënten in deze stadia met hormoonreceptor (HR)-positieve, HER2-negatieve of triple-negatieve borstkanker (TNBC) zijn er in aansluiting op hun definitieve behandeling geen verdere behandelopties tot het moment van progressie naar gemetastaseerde ziekte. Vanaf dat moment bedraagt de vijfjaarsoverleving met TNBC slechts 11,5% en met HR-positieve, HER2-negatieve ziekte 30,4%.
Studieopzet
Het hoofddoel van de ZEST-studie is te onderzoeken of het detecteerbaar worden van circulerend tumor-DNA (ctDNA), gevolgd door behandeling met de PARP-remmer niraparib, de ontwikkeling van radiologisch detecteerbare afstandsmetastasen kan voorkomen of uitstellen bij patiënten met een hoog risico op metastasering.1 Het detecteerbaar worden van ctDNA geldt als marker voor een verhoogd risico op het ontwikkelen van afstandsmetastasen. De primaire uitkomstmaat is de ziektevrije overleving (DFS) met niraparib in vergelijking met placebo. De belangrijkste secundaire uitkomstmaat is de algehele overleving (OS).
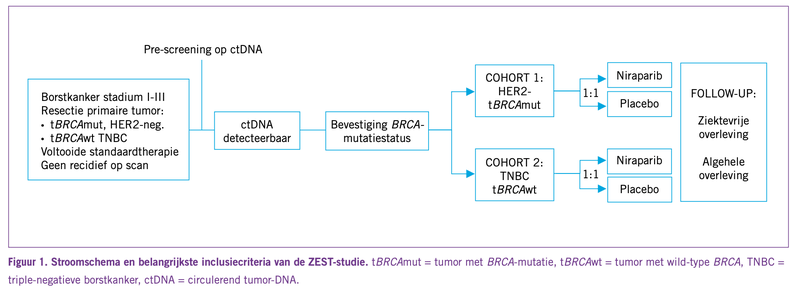
ZEST is een gerandomiseerde studie waaraan 57 ziekenhuizen deelnemen uit onder andere Europa en de Verenigde Staten. De studie omvat twee cohorten hoog-risicopatiënten met HER2-negatieve, stadium I-, II- of III-ziekte: patiënten met gemuteerd tumor-BRCA (tBRCA-mut), ongeacht de hormoonreceptorstatus (cohort 1), en patiënten met TNBC met wild-type tBRCA (tBRCAwt; cohort 2). In totaal zullen 800 patiënten geïncludeerd worden. Het is een door de industrie gesponsorde studie; de BOOG onderschrijft de studie en brengt deze onder de aandacht van haar leden, maar speelt er geen actieve rol in.
Sleutel voor inclusie
Het bijzondere aan de ZEST-studie is dat patiënten om voor inclusie in aanmerking te komen na voltooiing van een succesvolle behandeling van de primaire tumor, detecteerbaar ctDNA moeten hebben. Wim van der Steeg legt uit waarom dit relevant is: “In de dagelijkse praktijk controleren we patiënten in deze situatie eenmaal per jaar op lokale recidivering, maar we controleren niet actief op het ontstaan van afstandsmetastasen, omdat we hiermee geen relevant voordeel op de OS kunnen behalen. Er zijn nu data uit studies die laten zien dat ctDNA een sterk voorspellende waarde heeft voor het optreden van een klinisch of radiologisch recidief na afloop van de primaire behandeling. Als ctDNA detecteerbaar is geworden, ontwikkelen veel patiënten in de periode daarna afstandsmetastasen. Dit biedt, in ieder geval theoretisch, de gelegenheid om met een actieve behandeling te proberen de ontwikkeling van klinisch manifeste afstandsmetastasen te voorkomen of uit te stellen.”
Pre-screening
Potentiële deelnemers worden in de pre-screeningsfase elke drie maanden na de laatste standaardinterventie getest op ctDNA. De ctDNA-bepalingen worden centraal gedaan met een gevoelige test om de lage concentraties ctDNA die in deze setting verwacht worden, te detecteren. Van der Steeg weet: “Naar verwachting zal ongeveer 70% van de patiënten in deze pre-screening geen detecteerbaar ctDNA hebben. Daarom dient een relatief groot aantal patiënten gescreend te worden om uiteindelijk de 800 geplande patiënten te kunnen randomiseren.”
Voorafgaand aan randomisatie in de studie vindt, eveneens centraal, een test plaats om de BRCA-mutatiestatus van de primaire tumor te bevestigen. Patiënten met aantoonbaar ctDNA die nog geen afstandsmetastasen hebben en die ook voldoen aan alle overige inclusiecriteria, worden geïncludeerd in een van beide cohorten, afhankelijk van hun BRCA-mutatiestatus (zie Figuur 1).
Experimentele behandeling
PARP-remming heeft zijn waarde voor de behandeling van ovariumcarcinoom bewezen. Verschillende PARP-remmers, waaronder niraparib, zijn dan ook goedgekeurd voor deze indicatie. Er zijn echter ook sterke aanwijzingen dat PARP-remmers van waarde kunnen zijn bij borstkanker, in het bijzonder bij HER2-negatieve, BRCA-gemuteerde borstkanker en BRCA-gemuteerde TNBC. Olaparib en talazoparib hebben bijvoorbeeld klinische activiteit laten zien bij patiënten met deze vormen van borstkanker in de lokaal gevorderde en/of gemetastaseerde setting en zijn beide goedgekeurd voor de behandeling ervan.2,3
De inclusie van patiënten met TNBC zonder BRCA-mutatie in ZEST berust op het gegeven dat bij TNBC vaak sprake is van deficiënte homologe recombinatie (HRd). De aanwezigheid van HRd maakt borstkanker gevoelig voor PARP-remming en verhoogt de gevoeligheid voor andere antikankermiddelen, zo blijkt uit diverse studies.
Niraparib is niet geregistreerd voor de behandeling van borstkanker, maar heeft wel veelbelovende resultaten laten zien bij HER2-negatieve, BRCA-gemuteerde borstkanker. Zo liet niraparib klinische activiteit zien bij patiënten met BRCA-gemuteerde, gevorderde borstkanker en als neoadjuvante behandeling bij patiënten met BRCA-gemuteerde, gelokaliseerde borstkanker, in de meeste gevallen TNBC.4,5 Van der Steeg vindt niraparib ook qua veiligheid een verantwoorde keuze: “Dankzij de uitgebreide ervaring bij ovariumcarcinoom weten we dat het middel in het algemeen goed verdragen wordt en wat de bijwerkingen zijn. Mogelijke bijwerkingen die we vooral in het begin van de behandeling goed monitoren, zijn beenmergsuppressie, in het bijzonder trombopenie, en hypertensie.”
Nederlandse deelname
Behalve Isala nemen nog vijf Nederlandse ziekenhuizen deel aan de studie: Noordwest Ziekenhuisgroep (Alkmaar), HagaZiekenhuis (Den Haag), Medisch Centrum Leeuwarden, Maastricht UMC+ en Ikazia Ziekenhuis (Rotterdam). In alle deelnemende Nederlandse centra is de studie open. Volgens een nieuwsbrief van de sponsor waren half december in totaal 321 patiënten geïncludeerd in de pre-screeningsfase, waarvan 31 vanuit Nederland.
Behandelaars die mogelijke deelnemers willen verwijzen, wordt geadviseerd contact op te nemen met een collega bij een van de deelnemende centra. Van der Steeg merkt hierbij op dat ook patiënten die hun adjuvante behandeling al tot een jaar geleden hebben voltooid, nog in aanmerking kunnen komen voor deelname.
Referenties
1. Efficacy and Safety Comparison of Niraparib to Placebo in Participants With Either Human Epidermal Growth Factor 2 Negative (HER2-) Breast Cancer Susceptibility Gene Mutation (BRCAmut) or Triple-Negative Breast Cancer (TNBC) With Molecular Disease (ZEST). Te raadplegen via https://clinicaltrials.gov/ct2/show/NCT04915755
2. Robson M, et al. N Engl J Med 2017;377:523-33.
3. Litton JK, et al. N Engl J Med 2018;379:753-63.
4. Turner NC, et al. Clin Cancer Res 2021;27:5482-91.
5. Spring LM, et al. St. Gallen International Breast Cancer Conference 2021: abstr P095.
Dr. Marinus Lobbezoo, wetenschapsjournalist
Oncologie Up-to-date 2022 vol 13 nummer 2