




Mantelcellymfoom is een zeldzame, maar ongeneeslijke hematopoëtische maligniteit. Preklinisch onderzoek laat nu zien dat het eiwit hematopoëtischecelkinase in veel mantelcellymfomen sterk verhoogd tot expressie komt en dat dit geassocieerd is met een slechte prognose. Bovendien leidt onderdrukking van dit kinase tot een verminderde proliferatie en adhesie. Moleculair bioloog dr. Marcel Spaargaren en internist-hematoloog prof. dr. Marie José Kersten, beiden van het Amsterdam UMC, bespreken hoe deze resultaten kunnen bijdragen aan de ontwikkeling van een doelgerichte therapie bij mantelcellymfoom en twee andere maligniteiten.
Mantelcellymfoom (MCL) is een B-cel non-hodgkinlymfoom die vooral voorkomt bij ouderen en gekarakteriseerd wordt door de t(11;14)(q13;q32)-translocatie. De lymfoomcellen bevinden zich gewoonlijk in de lymfeklieren, het bloed en/of het beenmerg, maar typisch is ook de lokalisatie in de darm. Wat verder opvalt is dat 70% van de patiënten man is, hiervan is de onderliggende reden onduidelijk.
“Met een jaarlijkse incidentie van rond de 220 gevallen behoort MCL tot de zeldzamere maligniteiten.1 In tegenstelling tot bijvoorbeeld diffuus grootcellig B-cellymfoom is MCL niet te genezen, ook niet met intensieve behandeling. Wel bestaat er van MCL een variant met leukemische presentatie en een indolent ziekteverloop”, aldus Marie José Kersten. De vijfjaarsoverleving bij MCL is ongeveer 65%.1
“Als de patiënten voldoende fit zijn, behandelen we ze in de eerste lijn bij voorkeur met intensieve chemotherapie op basis van een afwisselend schema met R-CHOP en R-DHAP, gevolgd door chemotherapie met het BEAM-regime plus autologe stamceltransplantatie. Hierna wordt de patiënt nog behandeld met een driejarige onderhoudstherapie met rituximab. Oudere (>70 jaar) en/of minder fitte patiënten kunnen in de eerste lijn behandeld worden met R-CHOP, eventueel afgewisseld met R-HAD, gevolgd door onderhoudsbehandeling met rituximab. Patiënten met recidief of refractair MCL kunnen behandeld worden met verschillende therapieën, waaronder de BTK-remmer ibrutinib, bendamustine, lenalidomide en CAR-T-cellen. De meeste patiënten reageren goed op BTK-remmers, maar de responsen zijn helaas van vrij korte duur”, vertelt Kersten.
HCK
Hematopoëtischecelkinase (HCK) behoort tot de familie van SRC-tyrosinekinases en komt vrijwel uitsluitend voor in hematopoëtische cellen, waar het onder andere betrokken is bij proliferatie, adhesie en apoptose (zie Figuur 1). De onderzoeksgroep van dr. Steve Treon (Boston, Verenigde Staten) ontdekte een aantal jaren geleden dat HCK hoog tot expressie komt in de geactiveerde B-cel-type diffuus grootcellig B-cellymfomen (ABC-DLBCL) en in Waldenström’s macroglobulinemie (WM).2 Deze verhoogde expressie bleek te correleren met de aanwezigheid van mutaties in MYD88, een adaptereiwit dat een belangrijke rol speelt in de activering van de TLR-signaaltransductieroute door micro-organismen en de daaropvolgende immuunreactie (zie Figuur 1).
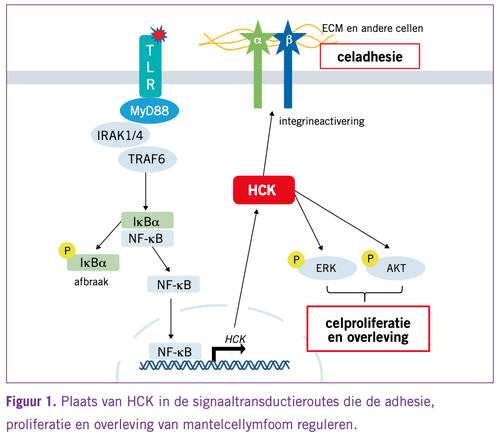
“Bij MCL is de incidentie van MYD88-mutaties laag, terwijl bij deze maligniteit de TLR-signaaltransductieroute opvallend vaak actief is.3 Hierdoor kwamen we op het idee om in MCL-cellen de HCK-expressie te bepalen. Uit het onderzoek van met name promovendus Hildo Lantermans (Amsterdam UMC) bleek dat in zowel MCL-lijnen als in primaire MCL’s HCK verhoogd tot expressie kwam, op een niveau dat vergelijkbaar is met dat van ABC-DLBCL en WM.4 Bij multipel myeloom en chronische lymfatische leukemie (CLL) komt de HCK-expressie overeen met die van normale B- en plasmacellen. Daarnaast nam de expressie van HCK verder toe als we MCL-cellen stimuleerden met TLR-liganden. Het is dus niet zo dat HCK alleen verhoogd tot expressie komt in cellen met een gemuteerd MYD88, activering van de TLR-signaaltransductieroute kan deze expressie ook verhogen. Toen we vervolgens de HCK-expressie onderzochten in een panel van primaire MCL’s, bleek dat een hoge (n=41) versus een lage HCK-expressie (n=81) gecorreleerd was met een significant slechtere algehele overleving (p=0,012)”, aldus Marcel Spaargaren.
Therapie
Vervolgexperimenten lieten zien dat de proliferatie van de MCL-cellen significant verminderde als de expressie van HCK werd geblokkeerd met RNA-interferentie. Spaargaren: “Daarnaast werd de integrine-gemedieerde adhesie van de cellen aan de extracellulaire matrix (ECM) geblokkeerd. Dit effect doet denken aan het effect van de BTK-remmer ibrutinib, die in eerste instantie niet cytotoxisch is, maar vooral de adhesie van MCL- en CLL-cellen aan de ECM en andere cellen vermindert. Hierdoor worden deze maligne cellen uit de beschermende en groeistimulerende omgeving van het beenmerg en de lymfoïde organen gemobiliseerd en komen ze in de circulatie terecht, waar ze uiteindelijk in apoptose gaan. In de eerste klinische studies met ibrutinib werd deze lymfocytose overigens nog wel eens verkeerd geïnterpreteerd en gezien als een teken van progressie.”
Op grond van bovenstaande bevindingen denken Spaargaren en Kersten dat HCK, net als BTK, bij patiënten met MCL een zeer geschikt target voor doelgerichte therapie kan zijn. Zij denken dit niet alleen vanwege de belangrijke rol van HCK in diverse biologische processen van MCL-cellen, maar ook vanwege de exclusieve expressie van deze kinase in hematopoëtische cellen, waardoor het risico op toxiciteit beperkt lijkt.
In het kader van doelgerichte therapie bleek recentelijk dat KIN-8194, een nieuwe remmer van zowel BTK als HCK, in vitro en in diermodellen cytotoxisch was voor ABC-DLBCL- en WM-cellen.5 In xenograftmodellen voor ABC-DLBCL met wildtype en gemuteerd BTK was KIN-8194 vergeleken met ibrutinib geassocieerd met een significant verbeterde overleving. Verder verhoogde combinatiebehandeling met de BCL2-remmer venetoclax de werkzaamheid van KIN-8194. “Deze duale BTK/HCK-remmer lijkt dan ook een veelbelovende kandidaat voor doelgerichte therapie bij patiënten met progressieve ziekte na behandeling met ibrutinib, vergelijkbaar met de niet-covalente BTK-remmer pirtobrutinib bij CLL. Momenteel onderzoeken wij de activiteit van KIN-8194 bij MCL”, aldus Spaargaren.
“Door dit soort preklinische studies begrijpen we steeds meer van de biologie en oncogenese van MCL. Steeds vaker leidt dit tot de ontwikkeling van nieuwe therapieën en wordt de kans groter dat we in de toekomst chemotherapie kunnen vervangen door minder toxische behandelingen. Mogelijk zijn dit combinatiebehandelingen met bijvoorbeeld een BTK/HCK-remmer en venetoclax”, aldus Kersten.
Referenties
1. Incidentie en overleving bij mantelcellymfoom (NKR). Te raadplegen via iknl.nl
2. Yang G, et al. Blood 2016;127:3237-52.
3. Akhter A, et al. Hematol Oncol 2017;35:79-86.
4. Lantermans HC, et al. Leukemia 2021;35:881-6.
5. Yang G, et al. Blood 2021;138:1966-79.
Dr. Robbert van der Voort, medical writer
Oncologie Up-to-date 2022 vol 13 nummer 1