



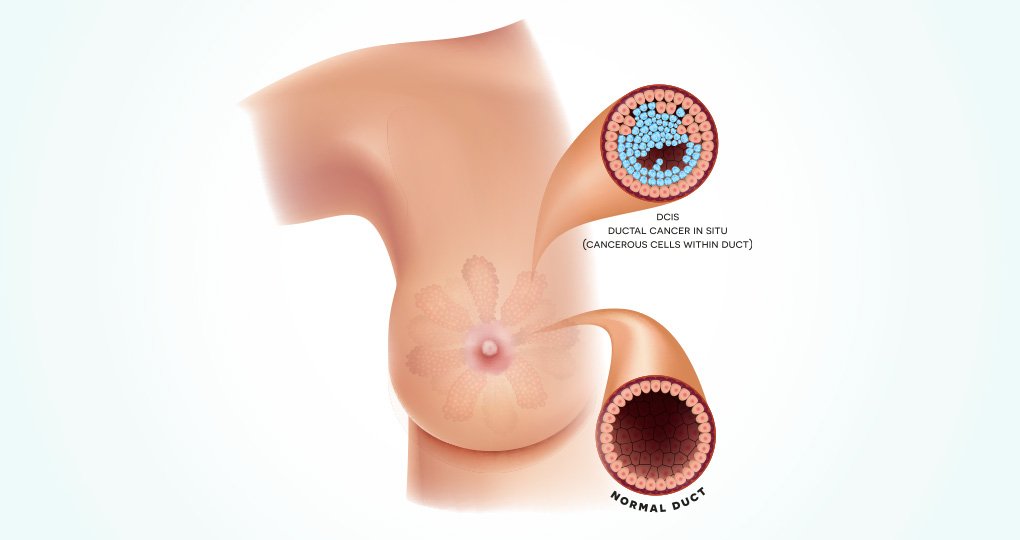
Mede door de LORD-studie staat ductaal carcinoma in situ (DCIS) volop in de belangstelling. Tijdens het 20e Bossche Mamma Congres (13-14 juni jl.) kwamen diverse aspecten van DCIS ter sprake. Van onderdiagnostiek van DCIS tot de respons op neoadjuvante, systemische therapie.
In de afgelopen dertig jaar is het aandeel van DCIS in het totaal aantal diagnoses van borstkanker fors toegenomen: van zo’n 3% naar meer dan 20%. Dat heeft alles te maken met de invoering van het bevolkingsonderzoek naar borstkanker en de daarbij gebruikte mammografie. Immers, DCIS geeft geen klachten, maar bevat wel calcificaties die op de mammografie zichtbaar zijn. “DCIS heet daarom wel een mammografic disease”, merkt prof. dr. Christiane Kuhl (Uniklinik Aachen, Duitsland) op in haar voordracht. Aangezien DCIS kan evolueren tot invasief mammacarcinoom, is behandeling ervan (chirurgie met of zonder aanvullende radiotherapie) tot nu toe de standaardaanpak bij DCIS. Dit vanuit de gedachte dat deze preventieve ingreep leidt tot minder diagnoses van invasief mammacarcinoom. Kuhl: “Dat effect is echter niet opgetreden, wat ertoe heeft geleid dat de diagnose DCIS door sommigen nu beschouwd wordt als een fout-positieve diagnose of op zijn minst overdiagnose.” Die opvatting gaat haar te ver. “Ja, DCIS zal niet altijd evolueren tot invasief mammacarcinoom, maar dat betekent niet dat alle DCIS onbelangrijk is en daarom overdiagnose genoemd kan worden. Sterker nog, er is juist sprake van onderdiagnose van DCIS.” Die conclusie is namelijk ook te trekken uit het genoemde uitblijven van een daling van het percentage diagnoses invasief mammacarcinoom, legt ze uit. “Volgens pathologen evolueren invasieve mammacarcinomen vanuit een DCIS-stadium. Het feit dat de behandeling van DCIS niet heeft geleid tot minder invasief mammacarcinoom, duidt er dus op dat we een groot deel van de DCIS nog missen met mammografie. Dat komt doordat deze DCIS geen calcificaties bevatten. Er is dus sprake van onderdiagnostiek van DCIS.”
MRI en toegenomen permeabiliteit
Dat dit zo is, heeft Kuhl aangetoond in een studie bij ruim 7.000 vrouwen, waarin zij de sensitiviteit van mammografie en MRI voor het detecteren van DCIS vergeleek. Waar de mammografie 56% van de (pathologisch bevestigde) DCIS opspoorde, was dat met MRI 92%. In de studie werd ook duidelijk dat mammografie vooral hooggradige DCIS mist wegens het gebrek aan calcificaties.1 Dat laatste sluit overigens goed aan bij de bevinding dat ruim de helft van alle invasieve mammacarcinomen die met mammografie zijn opgespoord geen calcificaties bevatten.
Dat DCIS zonder calcificaties wel zichtbaar is met (contrastversterkte) MRI komt doordat er sprake is van een toegenomen permeabiliteit van de wand van de melkgang waarin de DCIS zich bevindt, legt Kuhl uit.2 “Deze toegenomen permeabiliteit is het gevolg van lokale angiogenese en proteaseactiviteit die in gang gezet is door de DCIS. Dit suggereert dat juist deze DCIS de potentie hebben om te evolueren naar een invasief mammacarcinoom. Dit maakt MRI tot een belangrijk prognostisch hulpmiddel bij DCIS.”
Welke DCIS behandelen?
Met dat laatste raakt Kuhl de ‘heilige graal’ ten aanzien van DCIS. Welk DCIS zal evolueren tot een invasief mammacarcinoom (en behoeft dus behandeling) en welk niet (en kan desgewenst onbehandeld blijven)? De onderliggende aanname hierbij is uiteraard dat de latere invasieve tumor daadwerkelijk voortkomt uit de eerdere DCIS.
Dr. Esther Lips (Antoni van Leeuwenhoek, Amsterdam) heeft deze aanname recent onderzocht met behulp van genetische analyses. Hierbij vergeleek zij bij 95 vrouwen het genetische patroon van de DCIS (die behandeld werden met chirurgie en soms ook radiotherapie) met dat van de later bij hen ontstane ipsilaterale invasieve tumor.3 “Hierbij zagen we dat ongeveer 80% van de invasieve tumoren zodanig genetisch verwant waren aan de DCIS dat een klonale progressie uit de DCIS waarschijnlijk is. Bij de resterende 20% was de genetische overeenkomst tussen DCIS en de invasieve tumor echter zo gering dat het waarschijnlijk is dat de invasieve tumor niet is ontstaan uit de DCIS. Dit waren dus geen recidieven van DCIS, maar secundaire tumoren. Met andere woorden: het recidiefrisico van DCIS wordt enigszins overschat; in de praktijk is zo’n 20% van de ‘recidieven’ een secundaire tumor.”
Terug nu naar de ‘heilige graal’: welk DCIS behoeft behandeling, welk niet? De momenteel in Nederland lopende LORD-studie gaat voor een deel van de DCIS antwoord geven op deze vraag.4 “In de LORD-studie wordt onderzocht of het veilig is bij vrouwen met DCIS graad 1 of 2 de standaardbehandeling - bestaande uit chirurgie en eventueel radiotherapie - niet uit te voeren, maar in plaats daarvan de DCIS met een jaarlijks mammogram in de gaten te houden”, vertelt oncologisch chirurg dr. Frederieke van Duijnhoven (Antoni van Leeuwenhoek). Om met nog meer zekerheid laag-risico-DCIS te includeren, wordt ook immuunhistochemie uitgevoerd. Uitsluitend ER-positief, HER2-negatief DCIS wordt geïncludeerd. In de studie zijn inmiddels ruim 1.000 (van de beoogde 2.500) deelnemers geïncludeerd. Zij kiezen zelf voor welke onderzoeksarm zij in aanmerking komen (behandeling of afwachten). Nota bene: zij zijn allen geïncludeerd op basis van DCIS die is vastgesteld met een screeningsmammografie.
DCIS én invasief mammacarcinoom
DCIS kan ook voorkomen tegelijk met invasief mammacarcinoom. Zowel Van Duijnhoven als drs. Roxanne Ploumen, promovendus bij de afdeling Chirurgie van het Maastricht UMC+, onderzocht wat dit betekent voor de succeskans van neoadjuvante, systemische therapie bij HER2-positief, invasief mammacarcinoom en de verdere behandeling. Ploumen: “Wij hebben een retrospectieve studie gedaan op basis van data uit de Nederlandse Kankerregistratie en van Palga van circa 3.000 patiënten met HER2-positief, invasief mammacarcinoom.5 Bij 40% van de patiënten was naast de primaire tumor sprake van een DCIS-component. De primaire tumor van de patiënten met DCIS was iets vaker ER-positief dan die van patiënten zonder DCIS: 67% versus 60%.” De aanwezigheid van DCIS bleek van invloed op de uitkomst van de neoadjuvante therapie en de daaropvolgende (borstsparende) chirurgie. Ploumen: “Bij 50% van de patiënten met DCIS leidde de neoadjuvante behandeling tot een pathologisch complete respons van de primaire tumor, ten opzichte van bij 65% van de patiënten zonder DCIS. Ook was er bij de DCIS-patiënten vaker sprake van positieve snijvlakken: 13% versus 5%. Ongeveer de helft van die positieve snijvlakken werden veroorzaakt door de DCIS zelf. De neoadjuvante behandeling leidde bij 55% van de DCIS-patiënten tot het volledig verdwijnen van de DCIS.” Van Duijnhoven, die betrokken was bij een vergelijkbare studie6: “De aanwezigheid van DCIS bij invasief, HER2-positief mammacarcinoom ten tijde van de diagnose is in de praktijk aanleiding minder vaak te kiezen voor een borstsparende operatie. Nu we weten dat ongeveer de helft van de DCIS goed respondeert op de neoadjuvante systemische therapie, ligt het voor de hand na de neoadjuvante therapie via een biopt of diagnostische lumpectomie na te gaan of er nog sprake is van DCIS en wat de respons van de invasieve tumor op de neoadjuvante therapie is. Op grond van de uitkomsten daarvan kun je vervolgens besluiten of een borstsparende operatie mogelijk is of niet.”
Referenties
1. Kuhl CK, et al. Lancet 2007;370:485-92.
2. Kuhl CK. Radiology 2021;301:78-80.
3. Lips EH, et al. Nat Genet 2022;54:850-60.
4. BOOG 2014-04 LORD - studie (DCIS). Te raadplegen via kanker.nl
5. Ploumen RA, et al. 2023. Manuscript in voorbereiding.
6. Groen EJ, et al. Breast Cancer Res Treat 2021;189:213-24.
Dr. Marten Dooper, wetenschapsjournalist
Oncologie Up-to-date 2023 vol 14 nummer 4