




De behandeling van patiënten met een EGFR-gemuteerd niet-kleincellig longcarcinoom pas aanpassen als er sprake is van radiologische progressie betekent achter de feiten aanlopen. Het zorgt ervoor dat een deel van de patiënten te zwak is voor een vervolgbehandeling. Dr. Joop de Langen, longarts in het Antoni van Leeuwenhoek te Amsterdam, initieerde een klinische studie naar de vraag in hoeverre bij patiënten die worden behandeld met osimertinib seriële analyse van circulerend tumor-DNA (ctDNA) kan worden toegepast om in een eerder stadium het resistentiemechanisme te identificeren. “Bij patiënten met aangetoonde amplificatie van het MET-gen zal aan de behandeling een MET-inhibitor worden toegevoegd met het doel ziekteprogressie uit te stellen.”
Het ontstaan van resistentie is een belangrijke beperking bij de behandeling van niet-kleincellig longcarcinoom (NSCLC) met een EGFR-mutatie. Al geven gerichte behandelingen aanvankelijk een effectieve respons, later wordt nagenoeg iedere patiënt ongevoelig voor de betreffende medicatie. De track and treat in NSCLC (TATIN)-studie wil nagaan of dit moment eerder kan worden vastgesteld dan bij een CT-controle. De studie wordt mede ondersteund door Roche Diagnostics, een bedrijf dat zich onder andere bezighoudt met de genetische diagnostiek van longkanker.
“Wij hebben hen benaderd omdat zij de AVENIO ctDNA Expanded Kit hebben ontwikkeld, een next generation sequencing (NGS)-test speciaal voor de analyse van celvrij tumor-DNA in bloedsamples,“ vertelt Joop de Langen. “Deze kit bevat 197 genen, onder andere het gen dat codeert voor de epidermale groeifactorreceptor (EGFR) en het MET-gen. De behandeling valt verder geheel binnen onze standaardzorg. De patiënten hebben allemaal een indicatie voor de tyrosinekinaseremmer (TKI) osimertinib en tijdens die behandeling analyseren we om de zes tot acht weken hun bloed met de AVENIO-kit.” Zowel patiënten die osimertinib als eerstelijnsbehandeling ontvangen, als patiënten die de behandeling ontvangen na progressie op een eerste- of tweedegeneratie-EGFR-TKI op basis van een T790M-mutatie kunnen deelnemen.
Diverse resistentiemechanismen
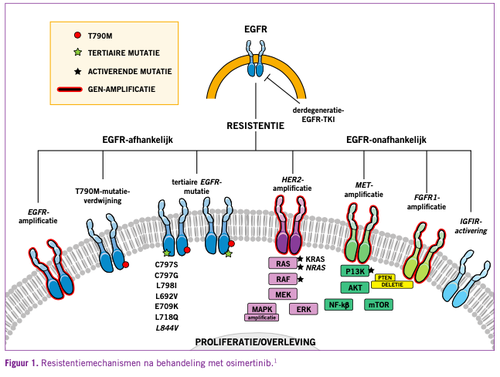
De EGFR bevat een extracellulair domein dat via een transmembraangedeelte in verbinding staat met het intracellulaire TK-domein (zie Figuur 1). Er kan resistentie ontstaan door een nieuwe mutatie in dat TK-domein: T790M. De bindingscapaciteit van een eerste- of tweedegeneratie-TKI wordt hierdoor sterk verlaagd ten opzichte van ATP, waardoor het medicament nauwelijks nog in staat is de receptoractiviteit te remmen. De derdegeneratie-TKI osimertinib bindt daar echter juist uitstekend aan. Tijdens osimertinibbehandeling kan vervolgens een derde mutatie optreden, bijvoorbeeld C797S, die maakt dat ook osimertinib niet meer aan het TK-domein kan binden. Bij dergelijke mutaties in het TKI-domein van de EGFR spreekt men van on-target resistentie. Er kan echter ook sprake zijn van activerende mutaties in andere transmembraanreceptoren die zo de activiteit van EGFR overnemen of omzeilen. Zo is bij 15% van de patiënten die progressie vertonen op osimertinib sprake van een MET-amplificatie. Tussen de intracellulaire signaleringsroutes van EGFR- en de MET-receptor-TK bestaan allerlei kruisverbindingen, waardoor de tumorceldeling weer sterk wordt gestimuleerd, ondanks adequate EGFR-remming. Zoiets kan trouwens ook gebeuren door een amplificatie van HER2 of FGFR-1. Deze mechanismen worden horizontale resistentie genoemd, omdat ze op hetzelfde niveau als de EGFR plaatsvinden. Daarnaast bestaat er verticale resistentie. Dit wordt veroorzaakt door activerende mutaties in eiwitten die downstream van EGFR het groeisignaal aan elkaar doorgeven door middel van fosforylering en op deze manier het groeisignaal transporteren van EGFR naar de celkern. Voorbeelden zijn KRAS- en BRAF-mutaties. Hoewel upstream EGFR nog adequaat wordt geremd door osimertinib, staat op een lager niveau het groeisignaal continu aan door een van deze activerende mutaties.
De Langen: “Al deze opties zijn meegenomen in de AVENIO-kit en we zien regelmatig dat in één bloedtest verschillende resistentiemechanismen tegelijkertijd aanwezig kunnen zijn. Zeer waarschijnlijk zitten deze niet in dezelfde tumorcel, maar betekent dit dat de ene tumorcel ontsnappingsroute A heeft genomen en de andere tumorcel ontsnappingsroute B. Dat maakt het gecompliceerd en tevens interessant. Het onderstreept het nut van dit onderzoek.”
Completer beeld
De bloedtest wordt binnen het Antoni van Leeuwenhoek al veelvuldig gebruikt. De Langen: “Het grote voordeel van de bloedtest is dat het een veel completer beeld geeft van het spectrum aan uitzaaiingen in het lichaam dan een biopt van één laesie; op al die plaatsen sterven immers tumorcellen af en komen er DNA-fragmenten in het bloed terecht. Een nadeel ten opzichte van een tumorbiopt is dat de test minder gevoelig is, doordat je naar minieme hoeveelheden tumor-DNA speurt in een bloedvolume van vijf à zes liter. Het testen van weefsel is veel gevoeliger, doordat het materiaal puurder is, maar daar zal je dus resistente tumorcelklonen missen die niet in het biopt zitten.
Inmiddels hebben we sterke aanwijzingen dat bloed- en weefseltests elkaar goed aanvullen. De reden om de bloedtest nu in een vroeger stadium in te zetten is dat vrijwel alle studies laten zien dat patiënten met tumorprogressie tijdens een behandeling snel achteruit kunnen gaan en dat uiteindelijk slechts 60-70% toekomt aan een volgende behandeling. We willen eigenlijk toe naar een behandeling die telkens wordt aangepast op basis van de ctDNA-bevindingen, met als doel progressie te voorkomen.”
Focus op MET-amplificatie
De TATIN-studie wil dus in feite twee vragen beantwoorden: ten eerste of het mogelijk is om resistentiemechanismen die optreden tijdens osimertinibbehandeling eerder aan te tonen in bloedsamples dan in tumorbiopten die worden genomen op het moment van radiologische progressie. Dus bij welk percentage patiënten kunnen resistente tumorcelklonen eerder worden opgespoord en hoeveel tijd zit er gemiddeld tussen detectie in bloed en radiologische progressie? Ten tweede of het zin heeft om de resistente tumorcelklonen al in een vroeg stadium te behandelen. Kan zo worden voorkomen dat ze uiteindelijk uitgroeien tot recidieven?
De Langen: “Om dat laatste goed te kunnen onderzoeken hebben we één vorm van resistentie geselecteerd, namelijk amplificatie van het MET-gen.” Bij andere patiënten bij wie op de CT-scan nog geen progressie is te zien zal het bloed mogelijk een ander resistentiemechanisme laten zien dan MET-amplificatie. “Ook al is zo’n resistentiemechanisme behandelbaar, dan zullen we dat toch niet inzetten. We willen een ondubbelzinnig verband leggen tussen wat we meten in het bloed en de progressie die we zien op de CT-scan. Vandaar de keuze voor één resistentiemechanisme en behandeling met een tegen MET gerichte TKI om te zien of zo’n resistente kloon inderdaad kan worden vernietigd. TATIN is in deze een proof-of-principle-studie.”
Inmiddels staat de teller op 28 geïncludeerde patiënten. De studie wordt momenteel geamendeerd, omdat osimertinibbehandeling is verplaatst naar de eerste lijn. “Door ook voldoende eerstelijnspatiënten te includeren kunnen we onderzoeken of het type resistentiemechanisme afhankelijk is van de lijn waarin osimertinib wordt gegeven.”
Dr. Jan Hein van Dierendonck, wetenschapsjournalist
Oncologie Up-to-date 2020 vol 11 nummer 2